Статьи по темам
Фотогалерея
Устойчиво неравновесное состояние водных растворов бикарбонатов
2009 г.
Воейков В.Л., До Минь Ха, Мухитова О.Г., Виленская Н.Д., Малышенко С.И., Богачук А.С.
МГУ им. М.В. Ломоносова, Биологический факультет, Москва, Россия
Дыхание служит основным источником энергии, обеспечивающей все жизненные функции организмов. В настоящее время аэробное дыхание сводят к митохондральному дыханию. Здесь кислород играет роль конечного акцептора электронов, отдавших свою энергию в электрон-транспортной цепи для синтеза АТФ, которая, как считается, обеспечивает энергетические потребности организма. Полвека тому назад А. Сент-Дьерди предположил, что существует и альтернативная система генерации энергии, в которой «горячие» электроны от их доноров прямо поступают на кислород [1]. Последовательное одноэлектронное восстановление кислорода до воды [O2 + (4e─ + 4H+) -> 2H2O] сопровождается освобождением больших квантов энергии (энергии высокой плотности), что позволяет поддерживать живую материю в высоко возбужденном состоянии. Такая форма генерации энергии характерна для горения. Выясняется, что существенная часть кислорода, потребляемого живыми системами, подвергается одноэлектронному восстановлению, т.е. участвует в процессах, аналогичных горению.
Одноэлектронное восстановление кислорода пока не связывают с биоэнергетикой. Действительно, трудно представить протекание горения в воде, составляющей основную субстанцию любой живой материи. Однако уже давно было доказано, что вода абсолютно необходима для реализации горения, хотя механизм ее участия в этом процессе до последнего времени оставался неясным [2].
В последнее время появились данные о том, что в жидкая вода в первом приближении представляет собой двухфазную систему [3, 4]. Одна из фаз представлена квази-жидко-кристаллическими доменами, другая -- менее организованной водой. Вода организованных доменов пребывает в электронно-возбужденном и когерентном состоянии, и может служить донором электронов, т.е. выступать в роли восстановителя. При определенных условиях может быть инициирована цепная реакция восстановления кислорода, который всегда присутствует в воде, электронами воды организованной фазы:
O2 + 2H2O -> 2H2O + O2 + энергия
Уникальная особенность такой реакции, по существу, горения воды – идентичность исходных реагентов и продуктов реакции. Тем не менее, горение воды, как и горение любого другого топлива, сопровождается выделением энергии. Молекулы воды в левой и в правой частях уравнения принадлежат разным структурам. Донором электронов служит организованная водная фаза (левая часть уравнения), разрушающаяся при окислении принадлежащих ей молекул воды. Появляющаяся при этом вода (правая часть уравнения) принадлежит менее организованной фазе. Таким образом, энергия, в этом процессе – структурная энергия в точном понимании этого термина Э.Бауэром. Молекулы воды из неорганизованной фазы могут вновь поступать в организованную, восстанавливая ее, что обеспечивает устойчивое функционирование системы, как единого целого.
Однако в идеально «чистой» водной системе «горение» воды вряд ли может реализоваться. Для его осуществления требуется, чтобы в системе были «дефекты», выступающие в роли катализаторов. Ими могут служить карбонаты:
CO2 <-> H2CO3 <-> HCO3─
Карбонаты вездесущи, а растворимость в воде CO2 на порядки выше растворимости в ней других основных природных газов. Давно известно, что для дыхания требуется поддержание карбонатов во внутренней среде организма не ниже некого порогового уровня. Так, животные при дефиците карбонатов погибают в первую очередь из-за прекращения дыхания мозга [5]. Карбонаты регулируют дыхание и на клеточном уровне; а in vitro они активируют ферменты, участвующие в одноэлектронном восстановлении кислорода [6]. Поскольку, как указывалось выше, существенная часть кислорода при дыхании расходуется на горение, при котором в роли «топлива» может выступать и вода, нельзя исключить, что карбонатные растворы и сами «дышат», генерируя энергию высокой плотности.
Ранее мы показали, что при добавлении реагента, содержащего соль Fe2+ и люминол, к находящимся в контакте с воздухом растворам бикарбонатов (РБ), в них развивается волна сверхслабого излучения (ССИ). Люминол представляет собой люминесцентный зонд на активные формы кислорода (АФК), промежуточные продукты одноэлектронного восстановления кислорода, а Fe2+ -- катализатор распада перекисей. Значит, в РБ спонтанно образуются АФК и накапливаются метастабильные пероксиды (H2On, где n=2-4), превращая ее в устойчиво неравновесную систему. При ее «раздражении» часть запасенной энергии освобождается в виде света [7]. Недавно мы обнаружили, что введение в слабые растворы бикарбонатов (1-5 mM) перекиси водорода в концентрациях всего 0,001-0,01% превращает их в устойчивые источники люминол-зависимого ССИ, даже если эти растворы находятся в полной темноте и при отсутствии контакта с воздухом. Ряд интересных особенностей поведения таких активированных РБ (АРБ) указывают, что им присущи некоторые свойства «дышащих» систем.
Сразу после инъекции H2O2 в растворы Na/KHCO3 (1-5 mM) интенсивность излучения может в течение 1-2 суток либо снижаться, либо возрастать. Затем ССИ стабилизируется вблизи некоторой средней величины и не затухает в течение многих недель и месяцев!
Некоторые вещества даже в сверхмалых дозах, которые принято называть «мнимыми», заметно влияют на среднюю интенсивность излучения из идентично приготовленных образцов. На рис. 1 представлена динамика излучения из тест-систем, содержащих 10─9, 10─11 и 10─12 М гидратированных фуллеренов (ГФ) (Гидратированные фуллерены (ГФ) – это водный раствор молекул фуллерена С60, заключенных в объемную оболочку из молекул воды [Andrievsky G.V. et al. Chem. Phys. Letters, 364, 8-17, 2002]. Выявлена как про-, так и антиоксидантная активность ГФ, т.е. они модулируют протекание ред/окс реакций. ГФ проявляют широкий спектр биологического действия как in vivo, так и in vitro) в сравнении с контролем. Видно, что после достижения квази-стационарного уровня интенсивность излучения растворов, содержащих 10─12 М ГФ, почти в 2 раза выше излучения в контроле, тогда как эффект более высоких концентраций ГФ менее выражен.
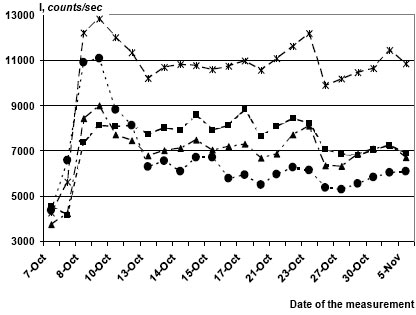
Рис. 1. Влияние ГФ на люминол-зависимое излучение из бикарбонатных растворов (5 мМ), в которые 07.10.2008 внесли Н2О2 (до 0,01%) и поместили по 1 мл в герметично закрытые пробирки. Контроль (без ГФ -- кружки), 10─9 М ГФ (квадраты), 10─11 М ГФ (треугольники), 10─12 М ГФ (звездочки).
В других экспериментах ГФ оказывали максимальное стимулирующее действие в разведениях, соответствующих «концентрациям» 10-15 и 10-19 M, тогда как ССИ промежуточных разведений не отличалось от контроля. Подобные парадоксальные дозовые зависимости характерны для действия сверхмалых доз биологически активных субстанций и в других тест-системах [8, 9].
Для более детального выявления закономерностей во временных параметрах вариабельности ССИ отдельные образцы с АРБ устанавливали в термостатируемую камеру детектора одиночных фотонов и непрерывно регистрировали ССИ в течение нескольких недель без вмешательства в процесс. Были обнаружены суточные ритмы с минимумом интенсивности ССИ в районе 7-9 часов утра и максимумом – в районе 6-8 часов вечера, хотя характер волн таких колебаний существенно отличался от одного дня к другому.
Более или менее регулярный суточный ритм был резко нарушен в течение недели, начавшейся 9 февраля 2009 г. В этот день в Москве наблюдалось полное лунное затмение. В 17:37 начался резкий подъем интенсивности излучения (рис. 2), что точно совпало по времени с началом затмения. Полное затмение наступило в 19:38, и точно в этот момент на графике наблюдается острый пик излучения. После окончания затмения интенсивность излучения не снизилась до исходных значений, а начала варьировать с характерным суточным ритмом на уровне, превышающем исходный в 2-3 раза. Точно через 48 часов после начала затмения интенсивность ССИ резко снизилась до значений, предшествовавших ему, а через 3 суток после затмения интенсивность ССИ вновь возросла более, чем в 2 раза, но вскоре упала до начального уровня.
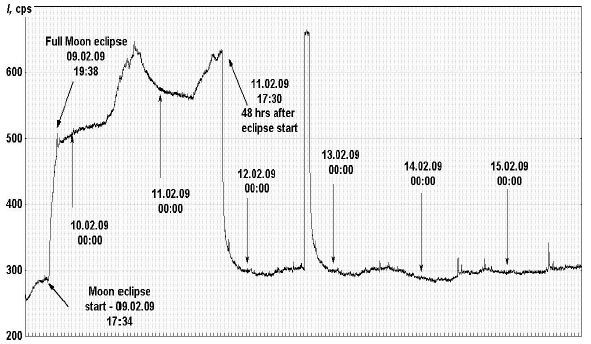
Рис. 2. Изменение интенсивности излучения в 5 мМ АБР за период с 09.02 по 15.02.2009.
Пока, по-видимому, преждевременно высказываться по поводу механизма взаимосвязи такого космо-физического явления, как лунное затмение, и вариаций излучения из активированных перекисью водных растворов бикарбонатов, хотя четкие корреляции между вариациями излучения и моментом наступления и максимумом лунного затмения трудно объяснить простыми совпадениями.
Еще одним указанием на сильно возбужденное состояние АБР служит резкое и длительное увеличение (иногда – в десятки раз) интенсивности ССИ в ответ на добавление к АБР небольших порций (1:10 – 1:50) БР или даже дистиллированной воды после ее предварительного перемешивания.
Таким образом, АРБ демонстрируют целый ряд необычных свойств, связанных с их способностью стабильно генерировать энергию электронного возбуждения, несмотря на то, что они закрыты для обмена веществом с окружающей средой и находятся в полной темноте. Из способности АРБ реагировать на действие факторов слабой и сверхслабой интенсивности значительным и длительным повышением интенсивности ССИ, следует, что они к тому же аккумулируют энергию высокой плотности. Пока преждевременно предлагать детальную модель процессов, отвечающих за устойчиво возбужденное состояние АРБ. Однако следует обозначить некоторые предпосылки, которые следует учесть при работе над такой моделью.
Как отмечалось, водные системы в первом приближении можно рассматривать как двухфазные – одна из фаз представляет собой донор электронов, а другая, менее организованная, содержит растворенные вещества, в частности кислород и карбонаты. Присутствующие в АБР карбонаты могут способствовать структурированию воды [10], увеличивая разность потенциалов между двумя фазами. Но, главное, за счет их способности участвовать в свободно-радикальных реакциях они могут катализировать «горение» воды. Так, HCO3─ легко восстанавливает один из продуктов расщепления воды, гидроксильный радикал (HO●), превращаясь в карбонатный радикал СО3─●. Последний может участвовать в образовании органических соединений, обладающих высоким восстановительным потенциалом, в частности, оксокарбонов [11]. Те, в свою очередь, могут инициировать появление новых циклических окислительно-восстановительных реакций. В результате в системе возникает сеть взаимно сопряженных реакций, а энергетический выход большинства из них обеспечивает генерацию энергии электронного возбуждения.
Для запуска любого эффективно протекающего разветвлено-цепного процесса (а рассматриваемый процесс относится к этому классу реакций) необходимо выполнение двух условий – преодоление пороговой начальной концентрации кислорода и энергетический импульс, «искру» для запуска далее уже самоподдерживающегося процесса [12]. H2O2, по-видимому, и играет эту двоякую роль. При введении в раствор бикарбоната часть ее быстро распадается, импульс освободившейся энергии запускает последующую цепь реакций. Одновременно в растворе увеличивается начальный уровень в воде кислорода. После инициирования горения освобождающаяся по ходу его энергия идет и на возбуждение как «топлива», так и кислорода, что поддерживает устойчивость этого процесса.
Каков бы ни был механизм, обеспечивающий устойчиво возбужденное состояние бикарбонатной системы, поддержание ее в таком состоянии требует постоянного расхода энергии, а, следовательно, энергия должна откуда-то черпаться. Естественным источником питающей систему энергии является тепловая. Поскольку структурная температура организованной воды ниже, чем находящейся с ней в контакте менее организованной водой, между этими двумя фазами существует температурный градиент, по которому от неорганизованной воды к организованной и течет поток энергии низкой плотности. Организованная вода трансформирует энергию низкой плотности в энергию высокой плотности – энергию электронного возбуждения. АБР, таким образом, представляет собой своеобразный повышающий трансформатор.
Существенная часть воды в живых системах пребывает в возбужденном жидкокристаллическом состоянии. С другой стороны, карбонаты – неотъемлемый компонент воды живых систем. В соответствии с предложенной здесь гипотезой катализируемый карбонатами окислительно-восстановительный цикл воды («горение воды» = «дыхание воды») служит первичным источником энергии живых систем, основой пребывания живой материи в устойчиво неравновесном высоко возбужденном состоянии, ее чувствительности к действию даже сверхслабых по интенсивности внешних раздражителей. Присущая водным растворам карбонатов способность находиться в устойчиво неравновесном состоянии может быть достаточным условием для возникновения, существования и развития живых систем.
Литература
1. Szent-Gyorgyi A. Introduction to a supramolecular biology. NY & London: Academic Press, 1960, pp. 128-129.
2. Voeikov V.L. (2005). Cell Mol Biol., 51: 663-675.
3. Zheng J.M., Chin W.C., Khijniak E., et al. ( 2006). Adv Colloid Interface Sci., 23: 19-27
4. Del Giudice E., Preparata G., Vitiello G. (1988). Phys. Rev. Lett., 611085-1088.
5. Henderson, Y. Adventures in Respiration. Modes of Asphyxiation and Methods of Resuscitation. Williams & Wilkins: Baltimore, 1938.
6. Medinas D.B., Cerchiaro G., Trindade D.F., et al. (2007). IUBMP Life, 59: 255-262
7. Voeikov V., et al. (2003) Clin. Lab., 49: 569.
8. Davenas E., et al. (1988). Nature, 333: 816-818.
9. Maltseva E.L., Palmina N.P., Burlakova E.B. (1998). Membrane & Cell Biology., 12: 251-268.
10. Pauling L. (1961) A molecular theory of general anesthesia. Science. 134, pp. 15-21
11. Mazellier P., et al. (2002). New J. Chem., 26: 1784–1790.
12. Voeikov V.L., Naletov V.I. (1998). In: «Biophotons». Jiin-Ju Chang, Joachim Fisch, Fritz-Albert Popp. Kluwer Academic Publishers. Dortrecht, The Netherlands, рр. 93-108
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии





 Нанотехнологии в водоочистке: достижения отечественной науки на службе здоровья.
Нанотехнологии в водоочистке: достижения отечественной науки на службе здоровья.
 Фильтры для воды "Геракл" с графеновым сорбентом: полный каталог и прайс-лист.
Фильтры для воды "Геракл" с графеновым сорбентом: полный каталог и прайс-лист.