Статьи по темам
Фотогалерея
Применение метода газоразрядной визуализации в изучении оптико-электронных свойств мононуклеаров мышей
*Сорокин О.В., *Абрамов В.В., *Казначеев В.П., **Коротков К.Г., **Борисова М.В.
* Институт Клинической Иммунологии СО РАМН, 2 СПбГУИТМО
В середине 60 годов В.П. Казначеевым была выдвинута гипотеза, что «кванты электромагнитного поля могут выступать одним из наиболее значимых материальных носителей потоков информации в биосистемах, выполняющих роль регулятора процессов обмена внутри клетки. Им было выдвинуто представление о биосистеме как о «неравновесной фотонной констелляции», существующей за счёт постоянного притока энергии извне. Эта констелляция «осуществляет связи в клетках, необходимые для сосуществования белково-нуклеиновых структур». Хранится квантовая информация в молекулярных соединениях клеточных структур и может извлекаться путём квантовой эмиссии при выполнении клетками различных физиологических функций.
Целью настоящего исследования явилось количественная оценка особенностей оптико-электронной эмиссии суспензии мононуклеаров мышей.
Материалы и методы.
Для регистрации параметров оптико-электронной эмиссии клеток мышей использована технология оценки характеристик газового разряда вокруг капли заданного объёма (10 мкл), находящейся на капилляре одноразового инсулинового шприца с насадкой, получаемой путём её нанесения вариационной пипеткой. Принципиальная схема метода газоразрядной визуализации приведена в монографии проф. Короткова К.Г.
Производилась запись 10 капель из различных проб (среда, клетки и т.д.) с частотой 30 кадров в секунду и продолжительностью воздействия электромагнитного поля 5 секунд. Дефектные видеозаписи сигнала подвергались визуальной выбраковке.
В качестве биологического материала использованы спленоциты и тимоциты мышей линии ( CBA * C 57 BL /6) F 1, полученные по стандартной методике. После выделения клеток производилась их сепарация на градиенте плотности фиколл-верографина, для получения мононуклеаров. Кроме того, данная процедура позволяет отделить живые клетка от нежизнеспособных и повреждённых клеток, что позволило в дальнейшем связать особенности оптико-электронной эмиссии именно с наличием в среде жизнеспособного клеточного материала. В качестве среды использовался раствор RPMI 1640 (Вектор, Новосибирск). Подсчёт клеток производился в камере Горяева по стандартной методике.
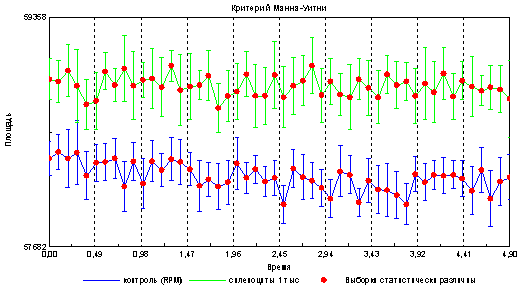
Результаты: Показано, что образец с клетками имеет достоверные различия по параметрам оптико-электронной эмиссии в отличие от контрольного образца, содержащего только среду RPMI рис 1 и 2 .
![]()
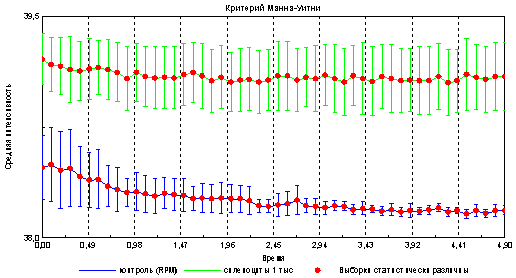
Рис . 2. Временная динамика изменения интенсивности эмиссии спленоцитов и среды.
Из приведенного графика видно, что площадь свечения капли, содержащей клетки достоверно больше площади свечения капли, состоящей только из среды ( RPMI ). Поскольку указанные образцы различаются только наличием клеточного материала, то рационально предположить, что данные различия привнесены именно спленоцитами мышей, имеющими особенности в оптико-электронных свойствах.
Интенсивность эмиссии в образцах содержащих спленоциты также выше, в отличие от контроля (капля со средой RPMI ).
Значит, клеточный материал имеет некоторые особенности оптико-электронной эмиссии, которые чётко определяются с помощью метода ГРВ. Возникает вопрос — имеется ли связь между показателями оптико-электронной эмиссии и функционально-структурными свойствами клеток? Если да, то это позволит в перспективе обнаружить ГРВ-предикторы клеточной морфологии и функциональной активности и, таким образом, использовать метод газоразрядной визуализации в медико-биологических исследованиях.
Следующим этапом настоящей работы было выяснение связи оптико-электронных параметров клеточной суспензии с количеством клеток. Обнаружено, что образцы, содержащие разное количество клеточного материала, имеют достоверные различия в параметрах оптико-электронной эмиссии. Задавалась фиксированная клеточность образца в 10 тыс и 100 тыс клеток на 10 мкл. Данные представлены на рис 3.
Из представленного графика видно, что с увеличением количества клеток в образце, увеличивается площадь эмиссии, что может быть связано с изменением объёмной емкости диэлектрика (капли, содержащей разное количество клеток).
Следующим этапом было выяснение вопроса о возможности регистрации с помощью метода газоразрядной визуализации различий при стимуляции клеток митогеном. Показано, что в опытном образце (к клеткам добавлен митоген) достоверно увеличивается площадь и снижается интенсивность эмиссии в сравнении с контролем (спонтанная пролиферация) рис 4 и 5.
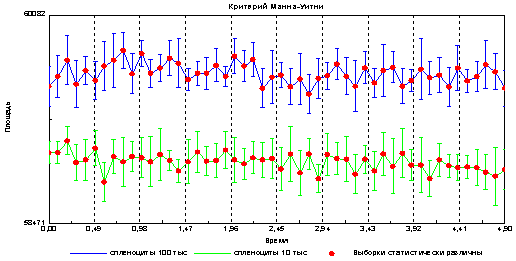
Рис3. Различия в площади эмиссии между образцами, содержащими 100 тыс и 10 тыс спленоцитов на 10 мкл
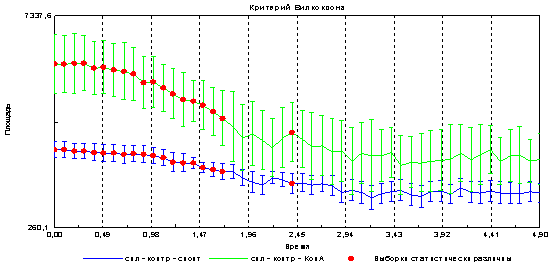
Рис. 4. Изменение площади эмиссии спленоцитов при спонтанной и митоген-индуцированной пролиферации
Предположительно увеличение площади свечения связано с увеличением клеточности в образце, что подтверждается данными на рис3. Изменения интенсивности свечения может быть связано со снижением электропроводности образца при увеличении количества клеток.
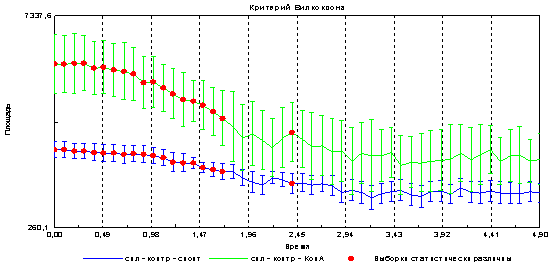
Рис. 5. Изменение интенсивности эмиссии спленоцитов при спонтанной и митоген-индуцированной пролиферации
В заключение показано, что фенотипические особенности связаны не только со структурными различиями, но и оптико-электронной эмиссией, в частности обнаружены различия между спленоцитами и тимоцитами мышей в образцах с равным количеством клеток в одинаковом объёме (10 мкл). Так различия в площади эмиссии, а также различия в интенсивности эмиссии между спленоцитами и тимоцитами мышей значительны: первые имеют значения площади эмиссии почти в три раза больше, значения же средней интенсивности свечения уменьшаются.
Обсуждение.
Извлечение информации о состоянии объекта (капля с заданным цитозом) происходит за счёт процессов нескольких уровней:
- Капля включена в цепь протекания электрического тока в системе связанных контуров, поэтому изменение комплексного сопротивления объекта за счёт изменения биологических процессов приводит к перераспределению токов контурах и сказывается на параметрах свечения. В частности, капля среды с клетками представляет собой систему с неоднородным распределением элементов различной проводимости вблизи поверхности, например ионы и другие молекулы, клеточная мембрана и т.д. Это приводит к формированию неоднородного рельефа распределения ЭМП вблизи поверхности, что влияет на характер развития разряда.
- Подача на поверхность капли короткого импульса напряжения при аппаратном ограничении протекающего импульсного тока вызывает клеточную реакцию. При этом характер этой реакции, по-видимому, зависит от исходной стадии клеточного цикла, что влияет на параметры изображения.
Выводы:
Таким образом, представленные данные вскрывают совершенно новый пласт явлений, лежащий в области квантовой биологии и связанный с существованием оптико-электронной эмиссии клеток. Регистрация этого феномена возможна благодаря инновационной технологии не имеющей аналогов в мировой практике и развитой коллективом российских учёных возглавляемых проф., д.т.н. Коротковым К.Г. – методом газоразразрядной визуализации. Каким образом стимулированная оптико-электронная эмиссия связана с функциональной активностью, структурной морфологией клетки и их изменениями при различных патологических состояниях предстоит выяснить в ближайшем будущем.
- Войдите или зарегистрируйтесь, чтобы получить возможность отправлять комментарии





 Нанотехнологии в водоочистке: достижения отечественной науки на службе здоровья.
Нанотехнологии в водоочистке: достижения отечественной науки на службе здоровья.
 Фильтры для воды "Геракл" с графеновым сорбентом: полный каталог и прайс-лист.
Фильтры для воды "Геракл" с графеновым сорбентом: полный каталог и прайс-лист.